Trung tâm lưu ký chứng khoán Việt Nam (VSD) thông báo đã thực hiện chuyển nhượng hơn 12,3 triệu cổ phiếu IMP của CTCP Dược phẩm Imexpharm (HoSE: IMP), tương ứng 24,9% vốn điều lệ cho SK Investment Vina III (thuộc tập đoàn đa ngành Hàn Quốc SK Group) trong ngày 29/5.
Phần lớn số cổ phiếu trên được mua lại từ nhóm quỹ thành viên của Dragon Capital như Vietnam Enterprise Investments Limited, Amersham Industries Limited, DC Developing Markets Strategies Public Limited Company.
Số còn lại đến từ một số quỹ khác như Kingsmead Vietnam and Indochina Growth Master Fund, Mekong Portfolio Investments Limited, Mirae Asset Maps Opportunity Vietnam Equity Balanced Fund I, Mirae Asset Maps Opportunity Vietnam & China Equity Investment Trust No.1 và Mirae Asset Variable Insurance Vietnam Equity Derivatives Investment Trust (H-USD).
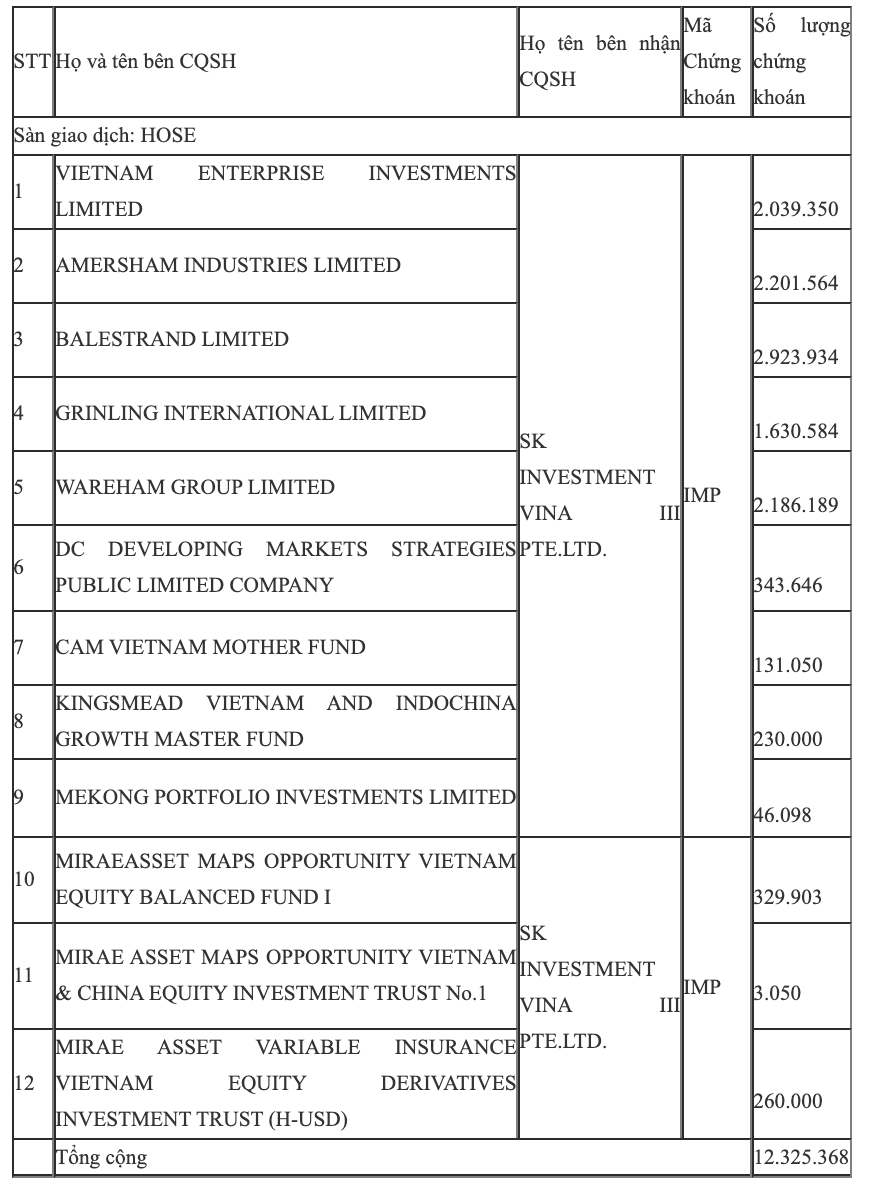 |
| Nguồn: VSD. |
Giá trị chuyển nhượng không được công bố. Tuy nhiên, chốt phiên giao dịch ngày 29/5, cổ phiếu có giá 54.200 đồng/cp. Tạm tính theo mức giá này, giao dịch có giá trị khoảng 667 tỷ đồng.
Ngoài SK Group, các cổ đông nước ngoài khác tại IMP gồm KWE Beteiligungen AG nắm 14,3%, VinaCapital nắm 6%. Cổ đông trong nước lớn nhất là Tổng Công ty dược Việt Nam – Vinapharm sở hữu 22,9% vốn.
Như vậy, với số cổ phần vừa nhận chuyển nhượng tương đương với 24,9% vốn, SK Group trở thành cổ đông lớn nhất tại IMP, vượt qua Vinapharm.
Việc nhận chuyển nhượng cổ phần của SK Group chỉ được thực hiện ngay trước Đại hội đồng cổ đông thường niên của IMP.
Có mặt tại Đại hội của IMP, ông Vũ Hữu Điền – Giám đốc đầu tư của Dragon Capital (DC) cho biết việc chuyển nhượng cổ phiếu này là để tái cơ cấu danh mục đầu tư.
Được biết trong năm 2020, IMP đặt kế hoạch tổng doanh thu đạt 1.750 tỷ đồng, tăng 23% so với thực hiện năm 2019. Công ty dự kiến không trích lập quỹ phát triển khoa học và công nghệ nên lãi trước thuế mục tiêu là 260 tỷ đồng, tăng 28%. Ban lãnh đạo IMP đánh giá chỉ tiêu này có nhiều thách thức trong bối cảnh dịch bệnh như hiện tại.
Ban lãnh đạo cho biết, năm 2020, nhà máy công nghệ cao Bình Dương (IMP4) dự kiến sẽ được phê duyệt EU và cấp chứng nhận EU-GMP vào cuối quý 3, kỳ vọng có thể đi vào sản xuất thương mại trong quý 4.
Về phần nhà máy Dược liệu và trung tâm kiểm nghiệm ở Đồng Tháp đã được triển khai từ cuối năm 2019, dự kiến hoàn thành trong năm 2020.