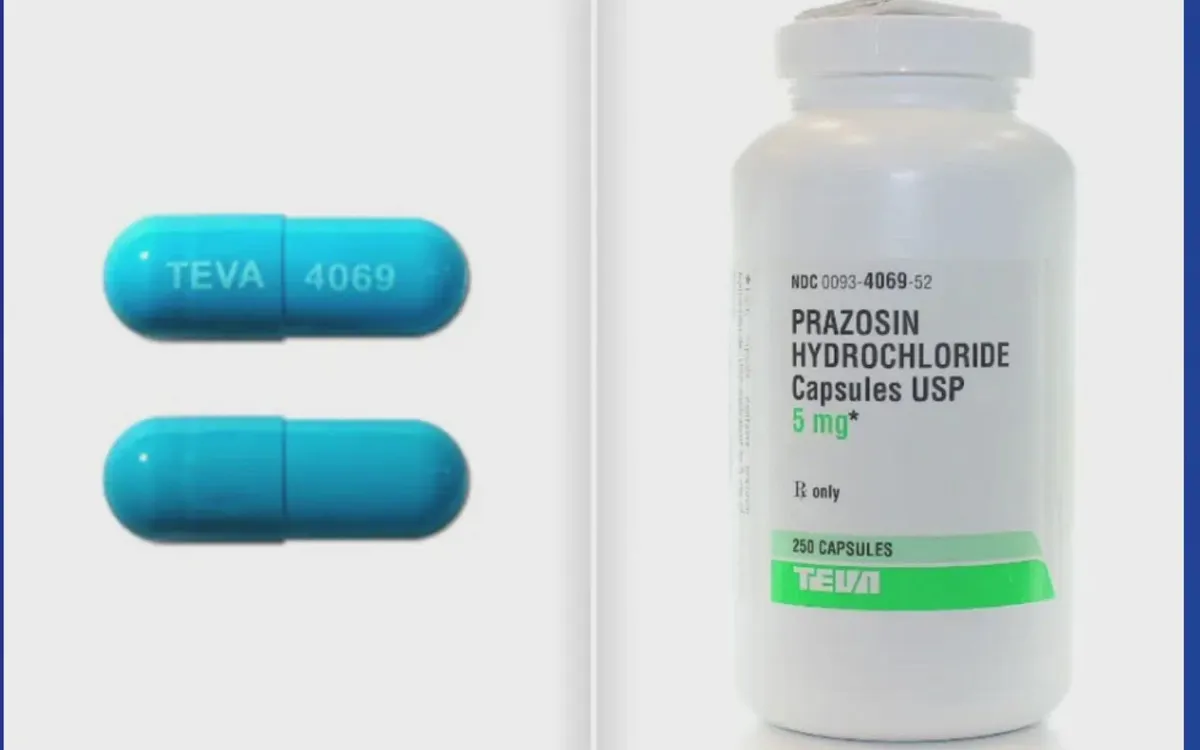
Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) thông báo, hơn 580.000 lọ thuốc điều trị huyết áp prazosin hydrochloride đã bị thu hồi trên toàn quốc, sau khi các cơ quan quản lý phát hiện hàm lượng tạp chất nitrosamine gây ung thư vượt ngưỡng an toàn cho phép.
Ảnh minh họa: WGRZ/VTV
Theo FDA, hai công ty dược Teva Pharmaceuticals USA (trụ sở tại bang New Jersey) và Amerisource Health Services đã tự nguyện tiến hành thu hồi sản phẩm vào đầu tháng 10, bao gồm nhiều lô thuốc prazosin ở các hàm lượng khác nhau đang lưu hành tại Mỹ.
Prazosin là loại thuốc phổ biến được bác sĩ kê đơn để giảm huyết áp nhờ khả năng giãn nở mạch máu, giúp cải thiện lưu thông máu. Ngoài ra, thuốc còn được sử dụng trong một số trường hợp điều trị rối loạn giấc ngủ và ác mộng liên quan đến hội chứng căng thẳng sau sang chấn (PTSD).
FDA cho biết, các lô thuốc bị thu hồi được xếp vào mức độ rủi ro cấp II, tức là có khả năng gây hậu quả sức khỏe tạm thời hoặc có thể phục hồi. Cơ quan này cảnh báo, một số viên thuốc có thể chứa tạp chất N-nitrosamine vượt ngưỡng an toàn cho phép.
Nitrosamine là nhóm hóa chất có thể hình thành trong quá trình sản xuất hoặc bảo quản thuốc, đặc biệt khi nguyên liệu hoặc điều kiện môi trường không được kiểm soát chặt chẽ. Nhiều nghiên cứu đã chỉ ra rằng phơi nhiễm lâu dài với nitrosamine có thể làm tăng nguy cơ mắc ung thư gan, phổi hoặc thận.
FDA khuyến cáo người bệnh không nên tự ý ngừng dùng thuốc nếu đang sử dụng prazosin, mà cần tham khảo ý kiến bác sĩ hoặc dược sĩ để được hướng dẫn đổi sang sản phẩm thay thế an toàn. Việc ngừng thuốc đột ngột có thể khiến huyết áp tăng vọt, dẫn đến nguy cơ đột quỵ hoặc đau tim.
Cơ quan này đồng thời cam kết tiếp tục giám sát chặt chẽ chuỗi cung ứng dược phẩm, phối hợp với các nhà sản xuất để đảm bảo tất cả sản phẩm lưu hành trên thị trường đều đáp ứng tiêu chuẩn an toàn.
Hiện Teva Pharmaceuticals và FDA chưa ban hành hướng dẫn chi tiết về việc xử lý thuốc thu hồi, song người dùng có thể tra cứu danh sách mã lô và thông tin sản phẩm trên báo cáo thực thi của FDA.
Trang dược phẩm GoodRx cũng khuyến nghị, khi phát hiện thuốc nằm trong danh mục thu hồi, người dùng cần ngưng sử dụng, thông báo cho nhà thuốc và tiêu hủy thuốc theo hướng dẫn an toàn của cơ quan y tế.
Vụ việc gióng lên hồi chuông cảnh báo về vấn đề kiểm soát chất lượng dược phẩm.