|
| Ảnh minh họa. |

9 loại trái cây 'vàng' giúp gymer tăng cơ, giảm mỡ bền vững
Bên cạnh protein, trái cây là nguồn dinh dưỡng quan trọng giúp người tập gym cải thiện hiệu suất, hỗ trợ tăng cơ, giảm mỡ và phục hồi thể lực sau tập.
 |
| Ảnh minh họa. |

Bên cạnh protein, trái cây là nguồn dinh dưỡng quan trọng giúp người tập gym cải thiện hiệu suất, hỗ trợ tăng cơ, giảm mỡ và phục hồi thể lực sau tập.

Củ riềng không chỉ tạo hương vị cho món ăn mà còn mang nhiều lợi ích cho sức khỏe như hỗ trợ tiêu hóa, giảm viêm, tăng đề kháng và phòng ngừa bệnh tật.

Chăm sóc sức khỏe, duy trì chế độ ăn phù hợp, vệ sinh cá nhân và khám định kỳ giúp phát hiện sớm, phòng ngừa ung thư vòm họng.

Tiêu thụ các chất phụ gia quá mức có thể gây ung thư, tiểu đường và rối loạn tiêu hóa. Người tiêu dùng cần thận trọng và chọn mua sản phẩm rõ nguồn gốc.

Cục An toàn thực phẩm (Bộ Y tế) có thêm lãnh đạo mới trong bối cảnh đơn vị này vừa qua xảy ra nhiều sai phạm liên quan đến công tác quản lý.

Người bị ung thư phổi nên kiêng các thực phẩm chế biến sẵn, nhiều dầu mỡ, đường tinh luyện và rượu bia vì chúng có thể làm tăng viêm, giảm hiệu quả điều trị.
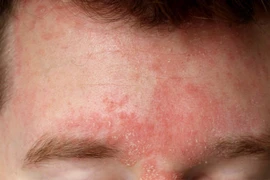
Thời tiết lạnh khô làm tăng nguy cơ các bệnh da như viêm da cơ địa, vảy nến, ngứa do lạnh và mày đay, cần chăm sóc đúng cách để phòng tránh.

Các loại thảo dược như tỏi, nghệ, mật ong, gừng, sả, hành, quế, kinh giới... có tác dụng kháng khuẩn, giảm viêm, hỗ trợ hệ miễn dịch tự nhiên, tốt cho sức khỏe.






Các loại thảo dược như tỏi, nghệ, mật ong, gừng, sả, hành, quế, kinh giới... có tác dụng kháng khuẩn, giảm viêm, hỗ trợ hệ miễn dịch tự nhiên, tốt cho sức khỏe.

Người bị ung thư phổi nên kiêng các thực phẩm chế biến sẵn, nhiều dầu mỡ, đường tinh luyện và rượu bia vì chúng có thể làm tăng viêm, giảm hiệu quả điều trị.

Thời tiết lạnh khô làm tăng nguy cơ các bệnh da như viêm da cơ địa, vảy nến, ngứa do lạnh và mày đay, cần chăm sóc đúng cách để phòng tránh.

Chăm sóc sức khỏe, duy trì chế độ ăn phù hợp, vệ sinh cá nhân và khám định kỳ giúp phát hiện sớm, phòng ngừa ung thư vòm họng.

Củ riềng không chỉ tạo hương vị cho món ăn mà còn mang nhiều lợi ích cho sức khỏe như hỗ trợ tiêu hóa, giảm viêm, tăng đề kháng và phòng ngừa bệnh tật.

Cục An toàn thực phẩm (Bộ Y tế) có thêm lãnh đạo mới trong bối cảnh đơn vị này vừa qua xảy ra nhiều sai phạm liên quan đến công tác quản lý.

Bên cạnh protein, trái cây là nguồn dinh dưỡng quan trọng giúp người tập gym cải thiện hiệu suất, hỗ trợ tăng cơ, giảm mỡ và phục hồi thể lực sau tập.

Tiêu thụ các chất phụ gia quá mức có thể gây ung thư, tiểu đường và rối loạn tiêu hóa. Người tiêu dùng cần thận trọng và chọn mua sản phẩm rõ nguồn gốc.

Lực lượng chức năng vừa phát hiện, thu giữ 10 tấn thực phẩm "bẩn" là nầm lợn, xúc xích… không rõ nguồn gốc xuất xứ tại phố Hưng Phúc, phường Yên Sở.

Cà phê giúp tỉnh táo nhưng uống sai thời điểm có thể gây phản tác dụng, khiến cơ thể uể oải, rối loạn tiêu hóa và mất ngủ. Dưới đây là 3 khung giờ nên tránh.
Nhận biết dấu hiệu đau thần kinh tọa sớm, chủ động thăm khám và điều trị đúng cách để giảm đau, cải thiện chất lượng cuộc sống.

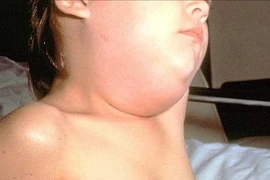
Quai bị lây qua đường hô hấp, gây nhiều biến chứng nguy hiểm. Phụ huynh cần nhận biết sớm và tiêm vaccine phòng bệnh hiệu quả.

Các sản phẩm mỹ phẩm của các doanh nghiệp từ Ba Lan, Nhật, Hàn, Pháp bị thu hồi do không còn nhu cầu kinh doanh.

Hơn 100 sản phẩm mỹ phẩm của KIN Việt Nam bị thu hồi do không còn nhu cầu kinh doanh.
Phẫu thuật nội soi nang ống mật chủ thành công, nâng cao hiệu quả điều trị và mang lại cơ hội hồi phục tốt cho các bệnh nhi mắc bệnh hiểm nghèo.
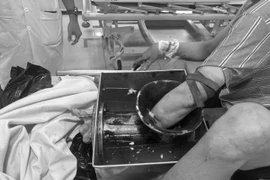
Một công nhân bị mất bàn tay do sơ suất khi vệ sinh máy xay thịt, nhấn mạnh tầm quan trọng của tuân thủ an toàn lao động để tránh tai nạn.