 |
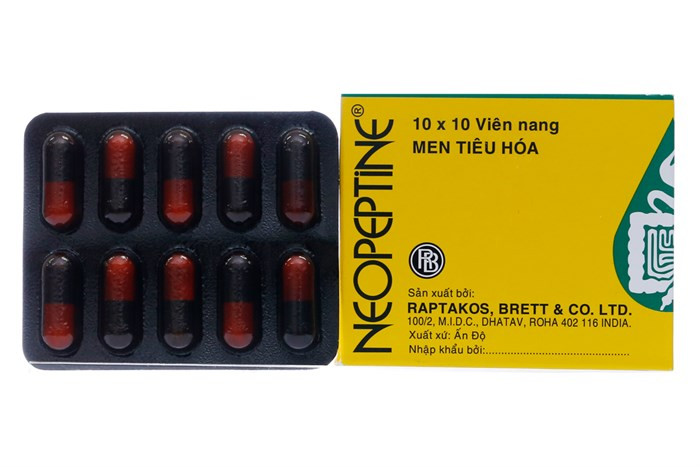
| Thuốc tiêu hóa Neopeptine của Công ty Raptakos, Brett&Co., Ltd (Ấn Độ) không đạt tiêu chuẩn chất lượng mức độ 2 |

 |
| Thuốc tiêu hóa Neopeptine của Công ty Raptakos, Brett&Co., Ltd (Ấn Độ) không đạt tiêu chuẩn chất lượng mức độ 2 |






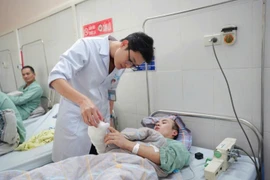


Sau khi được các bác sĩ phẫu thuật loại bỏ khối u, tình trạng sức khoẻ của bệnh nhân Đ.T.R. (Quảng Trị) phục hồi tốt, có thể xuất viện trong những ngày tới.

Trà tốt cho sức khỏe nhưng uống sai cách có thể gây đầy hơi, trào ngược, đau dạ dày và rối loạn tiêu hóa. Nhiều thói quen đang âm thầm gây hại.

Ăn chay không đúng cách, từ thực phẩm chế biến sẵn đến tinh bột tinh chế, có thể khiến bạn tăng cân thay vì giảm. Học cách ăn chay đúng đắn để duy trì vóc dáng.

Biết chọn lựa thực phẩm phù hợp và thói quen ăn uống hợp lý để hạn chế tổn thương, tránh biến chứng nguy hiểm cho dạ dày.

Dứa giúp tiêu hóa, tăng đề kháng, giảm viêm, làm đẹp da và củng cố xương khớp, nhưng cần ăn đúng cách để tránh tác dụng phụ.

Áp lực cuộc sống dễ khiến đời sống chăn gối nguội lạnh. Chỉ với vài thay đổi về dinh dưỡng, không gian và kết nối cảm xúc, cặp đôi có thể tìm lại sự thăng hoa.

Chế độ ăn Địa Trung Hải ưu tiên thực phẩm toàn phần, dầu ô liu, cá và rau củ, giúp phòng ngừa cao huyết áp, xơ vữa và đột quỵ lâu dài.

Khám phá cách xông hơi thảo dược giúp làm sạch, dưỡng ẩm và thư giãn, mang lại làn da sáng hồng tự nhiên phù hợp mọi loại da.

Ngay sau Tết, điều chỉnh chế độ ăn uống là bước quan trọng giúp cơ thể lấy lại vóc dáng và cân bằng năng lượng.

Bí quyết phân loại, vệ sinh và sắp xếp thực phẩm giúp tủ lạnh sạch sẽ, ngăn ngừa mùi hôi, bảo vệ sức khỏe gia đình.

Các loại hạt như óc chó, hạnh nhân, hạt điều, macca, hạt phỉ... hỗ trợ tim mạch và giữ cho huyết áp ổn định.

Tiếp xúc với ánh sáng xanh ảnh hưởng đến da và giấc ngủ. Áp dụng thói quen chăm sóc đúng cách để giữ da khỏe mạnh, trẻ trung hơn.

Chọn dâu hữu cơ, ăn trực tiếp và kết hợp với thực phẩm lành mạnh để tối ưu hóa lợi ích giảm huyết áp, bảo vệ sức khỏe tim mạch.