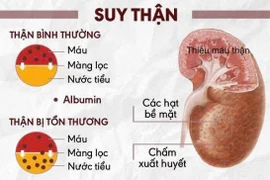
Cơ quan Quản lý Thực phẩm và Dược phẩm Mỹ (FDA) mới đây đã phê duyệt khẩn cấp liệu pháp bộ đôi kháng thể đơn dòng của AstraZeneca, gọi là AZD7442 hoặc Evusheld, giúp phòng ngừa COVID-19.
Liệu pháp này được cấp phép sử dụng ở người lớn và thanh thiếu niên (từ 12 tuổi trở lên, với cân nặng từ 40kg trở lên) bị suy giảm miễn dịch từ trung bình đến nặng do tình trạng bệnh lý hoặc sử dụng thuốc ức chế miễn dịch - những người có thể không tự sinh được miễn dịch đầy đủ với vắc xin COVID-19 cũng như những người không được khuyến cáo tiêm vắc xin COVID-19.
Liệu pháp AZD7442 áp dụng cho người đang không bị mắc COVID-19 hoặc gần đây chưa tiếp xúc với người bị nhiễm SARS-CoV-2.
 |
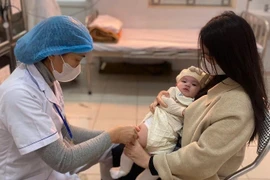
| Một người dân được tiêm vắc xin ngừa COVID-19 ở Mỹ hồi tháng 3/2021. Ảnh: Reuters. |
Được biết, quyết định phê duyệt khẩn cấp AZD7442 dựa trên thử nghiệm PROVENT giai đoạn III về dự phòng trước phơi nhiễm. Kết quả cho thấy, liệu pháp này giúp giảm 77% nguy cơ nhiễm nCoV có triệu chứng so với giả dược và hiệu quả tăng lên 83% trong phân tích sau theo dõi 6 tháng.
Dữ liệu từ thử nghiệm sau phơi nhiễm STORM CHASER giai đoạn III và thử nghiệm AZD7442 giai đoạn I cũng góp phần giúp liệu pháp này được cấp phép sử dụng khẩn cấp ở Mỹ.
Myron J. Levin, giáo sư Nhi khoa và Y khoa, Trường Y của Đại học Colorado, một trong những chủ nhiệm chính của thử nghiệm, cho biết: "Hàng triệu người Mỹ và toàn thế giới đứng trước nguy cơ nhiễm nCoV nghiêm trọng vì không tạo đủ đáp ứng miễn dịch, dù đã tiêm vắc xin. Tôi rất vui mừng được cung cấp AZD7442 đến họ. Đây là lựa chọn mới, dễ sử dụng, bảo vệ lâu dài, cần thiết giúp họ trở lại cuộc sống hàng ngày".
MenePangalos, Phó Chủ tịch Điều hành BioPharmaceuticals R&D thuộc AstraZeneca phát biểu: "Chúng tôi tự hào được đóng góp đáng kể trong cuộc chiến chống lại đại dịch COVID-19. Với sự phát triển của AZD7442, hiện chúng tôi đã có liệu pháp kháng thể đầu tiên được cấp phép tại Mỹ để ngăn chặn các triệu chứng của COVID-19 trước khi phơi nhiễm với virus, đồng thời mang lại sự bảo vệ lâu dài với một liều duy nhất.
Cho đến nay, AZD7442 trung hòa tất cả các biến thể của SARS-CoV-2, và chúng tôi đang nhanh chóng tiến hành nghiên cứu để đánh giá hiệu quả của liệu pháp này đối với biến thể Omicron".
Trước đó, vào ngày 5/10/2021, AstraZeneca thông báo đã gửi đề nghị đến Cơ quan Quản lý Thực phẩm và Dược phẩm Mỹ về việc Cấp phép Sử dụng Khẩn cấp cho AZD7442 để phòng ngừa COVID-19.
AstraZeneca đã đồng ý cung ứng cho chính phủ Mỹ 700.000 liều AZD7442. Nước này có kế hoạch phân phối sản phẩm đến các bang và vùng lãnh thổ miễn phí.
AstraZeneca đang đệ trình hồ sơ xin cấp phép khẩn cấp hoặc phê duyệt có điều kiện liệu pháp AZD7442 trong phòng ngừa và điều trị COVID-19 trên toàn cầu.
AZD7442 là sự kết hợp giữa hai kháng thể tixagevimab (AZD8895) và cilgavimab (AZD1061), chiết xuất từ tế bào bạch cầu của người đã nhiễm virus Corona chủng mới. Các kháng thể này được các chuyên gia của Trung tâm Y khoa Đại học Vanderbilt (Mỹ) phát hiện và cấp quyền sử dụng cho AstraZeneca từ tháng 6/2020.