 |
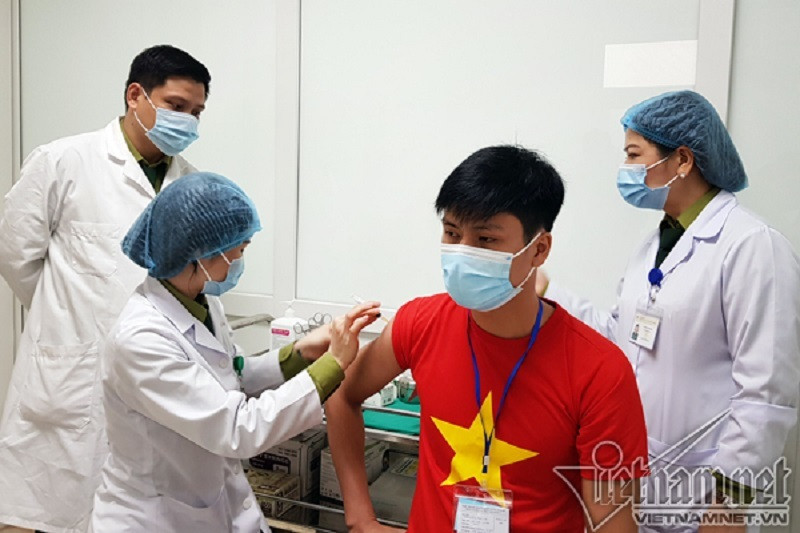
| Tình nguyện viên tham gia thử nghiệm giai đoạn 2 vắc xin Nanocovax tại Học viện Quân y. Ảnh: Thúy Hạnh |

 |
| Tình nguyện viên tham gia thử nghiệm giai đoạn 2 vắc xin Nanocovax tại Học viện Quân y. Ảnh: Thúy Hạnh |
Thói quen ngồi lâu, dùng điện thoại quá nhiều khiến đĩa đệm của người trẻ dễ tổn thương, cần chủ động phòng tránh sớm.

Thói quen ăn khuya làm chậm trao đổi chất, tích tụ mỡ, gây béo, mất ngủ, tiểu đường, bệnh tim và sỏi thận. Hãy kiểm soát ăn tối để bảo vệ sức khỏe.

Thói quen ngồi lâu, dùng điện thoại quá nhiều khiến đĩa đệm của người trẻ dễ tổn thương, cần chủ động phòng tránh sớm.

Thói quen ăn khuya làm chậm trao đổi chất, tích tụ mỡ, gây béo, mất ngủ, tiểu đường, bệnh tim và sỏi thận. Hãy kiểm soát ăn tối để bảo vệ sức khỏe.

Đi bộ ngược được nhiều người truyền tai nhau là tốt cho khớp gối và cột sống, nhưng không phải ai cũng hiểu đúng về lợi ích của hình thức vận động này.
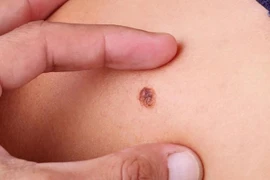
Phát hiện sớm ung thư da giúp điều trị hiệu quả. Các dấu hiệu như nốt u, mảng sần sùi, tổn thương bất thường cần chú ý.

Trà hoa hồng giúp chống viêm, giảm đau, hỗ trợ hô hấp, chống lão hóa, giảm cân, cải thiện giấc ngủ và giảm đau bụng kinh hiệu quả.

5 loại rau củ quen thuộc được ví như ‘kháng sinh tự nhiên’ mùa đông, giúp tăng đề kháng, chống viêm, giữ cơ thể khỏe mạnh và tràn đầy năng lượng.

Nghệ chứa hoạt chất curcumin, hỗ trợ giảm đau xương khớp, bảo vệ tim mạch, chống ung thư và giữ gìn vẻ đẹp tự nhiên.

Các loại thảo dược như tỏi, nghệ, mật ong, gừng, sả, hành, quế, kinh giới... có tác dụng kháng khuẩn, giảm viêm, hỗ trợ hệ miễn dịch tự nhiên, tốt cho sức khỏe.

Người bị ung thư phổi nên kiêng các thực phẩm chế biến sẵn, nhiều dầu mỡ, đường tinh luyện và rượu bia vì chúng có thể làm tăng viêm, giảm hiệu quả điều trị.

Củ riềng không chỉ tạo hương vị cho món ăn mà còn mang nhiều lợi ích cho sức khỏe như hỗ trợ tiêu hóa, giảm viêm, tăng đề kháng và phòng ngừa bệnh tật.

Bên cạnh protein, trái cây là nguồn dinh dưỡng quan trọng giúp người tập gym cải thiện hiệu suất, hỗ trợ tăng cơ, giảm mỡ và phục hồi thể lực sau tập.

Cà phê giúp tỉnh táo nhưng uống sai thời điểm có thể gây phản tác dụng, khiến cơ thể uể oải, rối loạn tiêu hóa và mất ngủ. Dưới đây là 3 khung giờ nên tránh.
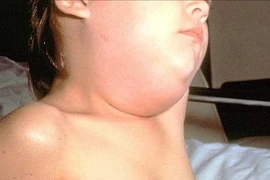
Quai bị lây qua đường hô hấp, gây nhiều biến chứng nguy hiểm. Phụ huynh cần nhận biết sớm và tiêm vaccine phòng bệnh hiệu quả.
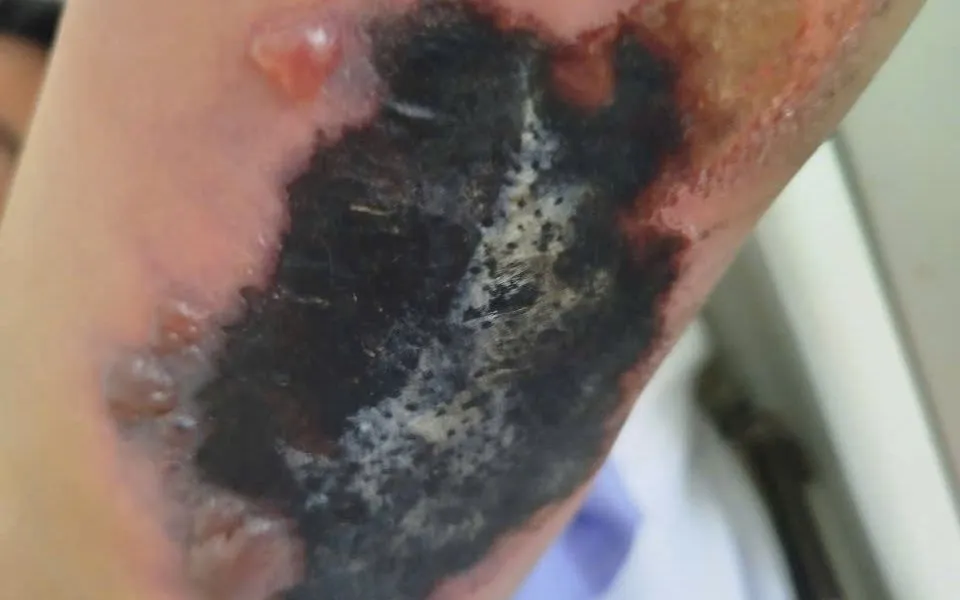
Kỹ thuật ghép da dày giúp xử lý các ca hoại tử da phức tạp ngay tại địa phương, đem lại hiệu quả rõ rệt và giảm tải cho tuyến trên.
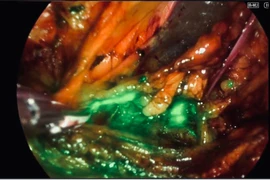
Ca phẫu thuật bằng kỹ thuật mới giúp giảm biến chứng, rút ngắn thời gian hồi phục, mở ra hướng đi mới trong điều trị ung thư nội mạc tử cung.

Hướng dẫn cách làm pate gan tại nhà đảm bảo an toàn, ngon, béo ngậy và giàu dinh dưỡng với công thức đơn giản.

Người dân cần tránh ăn tiết canh, thịt sống, vệ sinh sạch sẽ, dùng thực phẩm rõ nguồn gốc để phòng bệnh liên cầu lợn nguy hiểm và lây lan nhanh.

Trứng giúp kiểm soát cảm giác đói, tăng đốt cháy calo và kích thích trao đổi chất, là lựa chọn tối ưu cho bữa sáng giảm cân hiệu quả.

Một số loại trà không đường giàu chất chống oxy hóa như trà xanh, trà đen, trà dâm bụt… có thể hỗ trợ hạ đường huyết tự nhiên, tốt cho người đái tháo đường.

Bệnh nhân trẻ tuổi thoạt nhìn khỏe mạnh vẫn có thể mắc bệnh tim nặng, khám định kỳ giúp phát hiện và điều trị kịp thời để tránh biến chứng.