 |
| Nhiều lô biệt dược Valsartan bị thu hồi vì có chứa tạp chất gây ung thư - Ảnh: Một thế giới. |
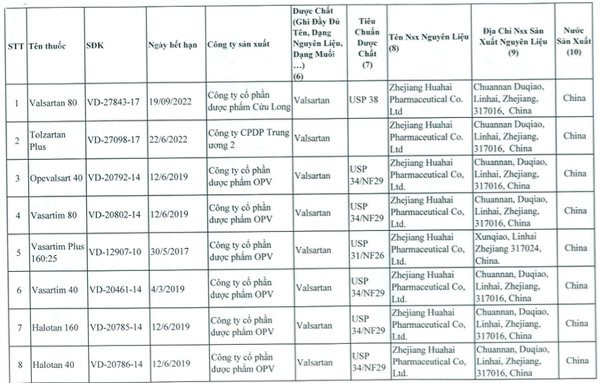 |
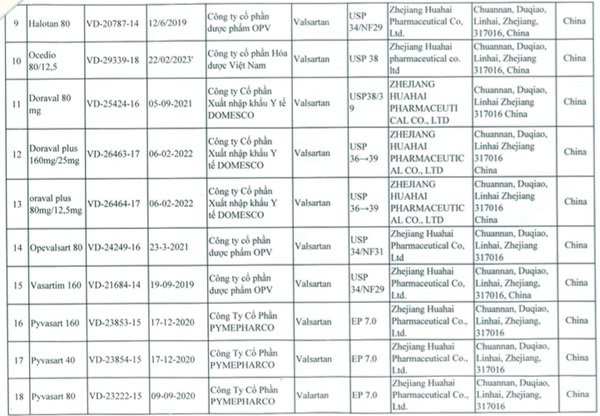
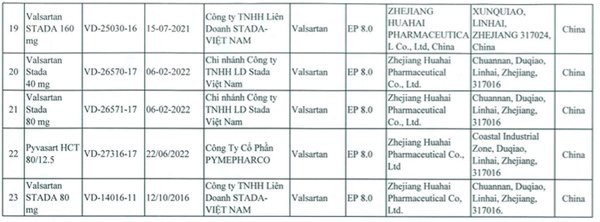
| Chi tiết 23 loại thuốc tim mạch chứa Valsartan có nguy cơ gây ung thư bị thu hồi. |
 |
 |
 |
| Nhiều lô biệt dược Valsartan bị thu hồi vì có chứa tạp chất gây ung thư - Ảnh: Một thế giới. |
 |
| Chi tiết 23 loại thuốc tim mạch chứa Valsartan có nguy cơ gây ung thư bị thu hồi. |
 |
 |

Sau khi được các bác sĩ phẫu thuật loại bỏ khối u, tình trạng sức khoẻ của bệnh nhân Đ.T.R. (Quảng Trị) phục hồi tốt, có thể xuất viện trong những ngày tới.

Sau khi được các bác sĩ phẫu thuật loại bỏ khối u, tình trạng sức khoẻ của bệnh nhân Đ.T.R. (Quảng Trị) phục hồi tốt, có thể xuất viện trong những ngày tới.

Trà tốt cho sức khỏe nhưng uống sai cách có thể gây đầy hơi, trào ngược, đau dạ dày và rối loạn tiêu hóa. Nhiều thói quen đang âm thầm gây hại.

Ăn chay không đúng cách, từ thực phẩm chế biến sẵn đến tinh bột tinh chế, có thể khiến bạn tăng cân thay vì giảm. Học cách ăn chay đúng đắn để duy trì vóc dáng.

Biết chọn lựa thực phẩm phù hợp và thói quen ăn uống hợp lý để hạn chế tổn thương, tránh biến chứng nguy hiểm cho dạ dày.

Dứa giúp tiêu hóa, tăng đề kháng, giảm viêm, làm đẹp da và củng cố xương khớp, nhưng cần ăn đúng cách để tránh tác dụng phụ.

Áp lực cuộc sống dễ khiến đời sống chăn gối nguội lạnh. Chỉ với vài thay đổi về dinh dưỡng, không gian và kết nối cảm xúc, cặp đôi có thể tìm lại sự thăng hoa.

Chế độ ăn Địa Trung Hải ưu tiên thực phẩm toàn phần, dầu ô liu, cá và rau củ, giúp phòng ngừa cao huyết áp, xơ vữa và đột quỵ lâu dài.

Khám phá cách xông hơi thảo dược giúp làm sạch, dưỡng ẩm và thư giãn, mang lại làn da sáng hồng tự nhiên phù hợp mọi loại da.

Ngay sau Tết, điều chỉnh chế độ ăn uống là bước quan trọng giúp cơ thể lấy lại vóc dáng và cân bằng năng lượng.

Bí quyết phân loại, vệ sinh và sắp xếp thực phẩm giúp tủ lạnh sạch sẽ, ngăn ngừa mùi hôi, bảo vệ sức khỏe gia đình.

Các loại hạt như óc chó, hạnh nhân, hạt điều, macca, hạt phỉ... hỗ trợ tim mạch và giữ cho huyết áp ổn định.

Tiếp xúc với ánh sáng xanh ảnh hưởng đến da và giấc ngủ. Áp dụng thói quen chăm sóc đúng cách để giữ da khỏe mạnh, trẻ trung hơn.

Chọn dâu hữu cơ, ăn trực tiếp và kết hợp với thực phẩm lành mạnh để tối ưu hóa lợi ích giảm huyết áp, bảo vệ sức khỏe tim mạch.

Trái cây chứa vitamin C, phytochemicals giúp trẻ nhỏ chống lại vi khuẩn, virus, nâng cao hệ miễn dịch tự nhiên trong mùa lạnh.
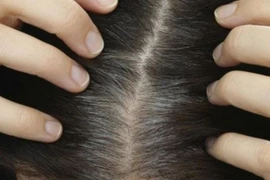
Tóc bạc sớm cảnh báo nhiều vấn đề về sức khỏe, từ gen, stress đến dinh dưỡng. Học cách chăm sóc tóc đúng cách để giữ mái tóc đen mượt lâu dài.

Không chỉ là thức uống “healthy”, sinh tố xanh còn giúp no lâu, hỗ trợ tiêu hóa, giảm tích mỡ và nuôi dưỡng làn da từ bên trong khi bổ sung hợp lý mỗi ngày.

Chăm sóc sức khỏe chủ động, vệ sinh cá nhân và giữ ấm giúp phòng tránh các bệnh hô hấp và tiêu hóa trong thời tiết thay đổi đột ngột.

Không chỉ ngon miệng, nho đen còn chứa nhiều chất chống oxy hóa mạnh như resveratrol, giúp bảo vệ tim mạch, não bộ, hỗ trợ giấc ngủ và làm chậm lão hóa.

Chuẩn bị sinh con, nhiều chị em quan tâm cách tăng khả năng thụ thai. Bác sĩ khuyến nghị 4 nhóm thực phẩm giúp bồi bổ buồng trứng, cải thiện chất lượng trứng.

Tìm hiểu cách chọn kem lót, kem nền và phấn phủ phù hợp từng loại da để giữ lớp trang điểm tươi mới và tránh gây hại cho da.