Euvipharm sản xuất thuốc không rõ nguồn gốc được xem là thuốc giả?
(Kiến Thức) - Chuyên gia dược học khẳng định, từ việc thuốc Euvipharm không rõ nguồn gốc nguyên liệu có thể được xem là doanh nghiệp đã, đang có hành vi sản xuất thuốc giả.
Theo quyết định mới đây của Cục Quản lý Dược (Bộ Y tế), Dược phẩm Euvipharm bị đình chỉ sản xuất thuốc 3 tháng do sai phạm trong hoạt động sản xuất thuốc. Cụ thể, quyết định số 242/QĐ-QLD ngày 09/6/2016 của Cục trưởng Cục Quản lý Dược, Dược phẩm Euvipharm đã sử dụng nguyên liệu làm thuốc không rõ nguồn gốc xuất xứ để sản xuất thuốc.
 |
| Dược phẩm Euvipharm làm mất lòng tin của người tiêu dùng với hành vi sản xuất thuốc không rõ nguồn gốc, không đúng đăng kí chất lượng. |
Có bề dày hơn 10 năm hoạt động và luôn được quảng cáo là “chuẩn mực nhất tại Việt Nam” nhưng vụ việc sản xuất thuốc từ nguyên liệu không rõ nguồn gốc đã khiến người tiêu dùng mất lòng tin vào Euvipharm. Nhiều chuyên gia dược học còn khẳng định hành vi sản xuất thuốc không rõ nguồn gốc, không đúng tiêu chuẩn đăng kí của Euvipharm không khác gì sản xuất thuốc giả.
Trao đổi với PV Kiến Thức, Ông Nguyễn Xuân Hùng, Phó chủ tịch Hội Dược học Việt Nam cho biết : “Hành vi sản xuất thuốc từ nguyên liệu không rõ nguồn gốc xuất sứ được coi là hành vi sản xuất thuốc giả. Điều này có nguy cơ rất lớn khi mà đã có nhiều sản phẩm được bán ra thị trường, có những ảnh hưởng đến sức khoẻ của người sử dụng”.
 |
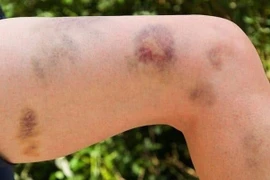
Một trong 38 loại thuốc mà Dược phẩm Euvipharm sản xuất từ nguyên liệu không rõ nguồn gốc.
|
Tìm hiểu của
Kiến Thức cho thấy, theo thông tư “Hướng dẫn việc quản lý chất lượng thuốc năm 2010 của Bộ Y tế” thì: Nguyên liệu làm thuốc là chất tham gia vào thành phần cấu tạo sản phẩm trong quá trình sản xuất thuốc. Thuốc kém chất lượng là thuốc không đạt tiêu chuẩn chất lượng đã đăng ký với cơ quan có thẩm quyền. Thuốc giả là sản phẩm được sản xuất dưới dạng thuốc với ý đồ lừa đảo, thuộc một trong những trường hợp sau đây: Thứ nhất là không có dược chất, thứ 2 là có dược chất nhưng không đúng hàm lượng đã đăng ký, thứ 3 là có dược chất khác với dược chất ghi trên nhãn, thứ 4 là mạo tên, kiểu dáng công nghiệp của thuốc đã đăng ký bảo hộ sở hữu công nghiệp của cơ sở sản xuất khác. Trong thông tư này, điều 11 quy định về việc “Kiểm tra chất lượng thuốc tại cơ sở kinh doanh thuốc” thì: “Tất cả các thuốc (kể cả nguyên liệu, bao bì) đều phải được kiểm tra chất lượng; chỉ khi đạt tiêu chuẩn chất lượng và phù hợp với các quy định có liên quan của pháp luật mới được đưa vào sản xuất, pha chế và lưu hành”.
 |
Nhiều loại thuốc sản xuất từ nguồn nguyên liệu không rõ nguồn gốc của Dược phẩm Euvipharm là các loại thuốc quen thuộc được người dân sử dụng.
|
Về vụ việc thuốc Euvipharm không rõ nguồn gốc nguyên liệu, không đạt chuẩn nói trên, ông Nguyễn Huy Quang, Vụ trưởng Vụ Pháp chế Bộ Y tế, nhấn mạnh: "Việc Dược phẩm Euvipharm bị đình chỉ sản xuất 3 tháng như hiện nay chỉ là bước đầu. Bởi cần phải xét đến các phương thức làm trái quy định pháp luật về việc sản xuất thuốc của doanh nghiệp này, làm rõ yếu tố doanh nghiệp có cố ý hay không, quy mô sản phẩm đã sản xuất và bán ra thị trường".
Cũng theo ông Nguyễn Huy Quang cho biết thêm: “Sản xuất thuốc không rõ nguồn gốc, không đúng tiêu chuẩn là phạm pháp. Pháp luật Việt Nam đã quy định rất rõ để có tính răn đe với các doanh nghiệp cố ý làm trái các quy định.”
Như vậy, việc Dược phẩm Euvipharm bị đình chỉ sản xuất 3 tháng được xem là thích đáng hay không? Khi nào các cơ quan chức năng sẽ có kết luận cuối cùng để chấn an dư luận về mảng thuốc - y tế - sức khỏe? Đối chiếu theo luật pháp hiện hành, Dược phẩm Euvipharm sẽ vi phạm theo điều nào của Bộ luật Hình sự....
Kiến Thức sẽ tiếp tục thông tin đến bạn đọc.