 |
| Vắc xin phòng Covid-19 Nanocovax |

 |
| Vắc xin phòng Covid-19 Nanocovax |
Khu đất nuôi cá tầm của ông Nhuận rộng hơn 2.000m2 nằm ở cuối xóm Đồng Chuối, ngay dưới chân núi Voi Đầm (huyện Võ Nhai, tỉnh Thái Nguyên.
Trước năm 2018, trên đất này, người dân chủ yếu trồng keo và một số loại cây khác. Nhận thấy khu đất có khí hậu mát mẻ, cộng thêm nguồn nước lạnh luôn dồi dào và ổn định, rất thích hợp để nuôi cá tầm, ông Nhuận cùng với 3 anh em của mình là ông Hoàng Văn Trường, Hoàng Văn Kiên và Hoàng Văn Quảng đã bàn bạc và thống nhất cùng nhau tìm hiểu và gây dựng mô hình nuôi cá tầm.
Sáng 2/8, GS Trần Văn Thuấn, Thứ trưởng Y tế, Tổ trưởng Tổ công tác đặc biệt về nghiên cứu thử nghiệm lâm sàng, phát triển vắc xin phòng Covid-19 chủ trì cuộc họp trực tuyến với các nhà khoa học và các đơn vị nghiên cứu để thúc đẩy nhanh tiến độ thử nghiệm vắc xin Nanocovax.
Hiện tại vắc xin Nanocovax đang thử nghiệm pha 3 trên 13.000 tình nguyện viên tại 4 tỉnh, chia làm 2 giai đoạn nhỏ (3a gồm 1.000 người và 3b với 12.000 người).
Sáng 7/8, Hội đồng đạo đức, Bộ Y tế tổ chức cuộc họp thẩm định giai đoạn 1, giữa kỳ giai đoạn 2 vắc xin ngừa Covid-19 Nanocovax của Công ty Nanogen. Cuộc họp do GS Trương Việt Dũng, Chủ tịch Hội đồng đạo đức và Y sinh học quốc gia chủ trì.
Thứ trưởng Y tế Trần Văn Thuấn, Tổ trưởng Tổ công tác đặc biệt về nghiên cứu thử nghiệm lâm sàng, phát triển vắc xin phòng Covid-19 được mời tham dự.

Dù giàu protein và vitamin, cá lóc cần hạn chế với người mắc bệnh gout, gan, thận hoặc dị ứng để tránh rủi ro sức khỏe.

Thay vì các phương pháp “detox” nguy hiểm, hãy duy trì thói quen uống đủ nước, ăn rau quả, ngủ đủ giấc và vận động nhẹ nhàng để giữ gìn sức khỏe lâu dài.

Bảo quản thực phẩm trong tủ lạnh không đúng cách hoặc để quá thời gian khuyến nghị, thực phẩm vẫn có thể bị nhiễm khuẩn, gây ngộ độc.

Bổ sung nước, ăn uống cân bằng thực phẩm và lối sống lành mạnh giúp gan khỏe mạnh, giảm tổn thương do rượu bia gây ra.

Bảo quản thực phẩm trong tủ lạnh không đúng cách hoặc để quá thời gian khuyến nghị, thực phẩm vẫn có thể bị nhiễm khuẩn, gây ngộ độc.

Thay vì các phương pháp “detox” nguy hiểm, hãy duy trì thói quen uống đủ nước, ăn rau quả, ngủ đủ giấc và vận động nhẹ nhàng để giữ gìn sức khỏe lâu dài.

Dù giàu protein và vitamin, cá lóc cần hạn chế với người mắc bệnh gout, gan, thận hoặc dị ứng để tránh rủi ro sức khỏe.

Bổ sung nước, ăn uống cân bằng thực phẩm và lối sống lành mạnh giúp gan khỏe mạnh, giảm tổn thương do rượu bia gây ra.
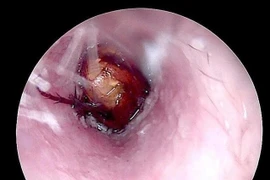
Khi phát hiện côn trùng chui vào tai, người bệnh đã đến tiệm cắt tóc để lấy nhưng không được, sau đó được người nhà đưa đến bệnh viện thăm khám.

Vẻ đẹp trầm lắng, chất thơ và nhịp sống chậm giúp Huế lọt top điểm đến trăng mật lãng mạn nhất thế giới 2026, ghi dấu ấn trên bản đồ du lịch.

Nồm ẩm khiến sàn nhà “đổ mồ hôi”, đồ đạc ẩm mốc và bốc mùi khó chịu. Chỉ với vài mẹo đơn giản dưới đây đã bạn có thể giữ không gian sống luôn khô ráo, dễ chịu.

Các chuyên gia cảnh báo tác hại của bụi mịn đối với mắt, khuyến khích người dân theo dõi chất lượng không khí và thực hiện các biện pháp bảo vệ đúng cách.

Theo chuyên gia, khi được chăm sóc đúng cách, quất cảnh có thể trở thành cây cảnh lâu năm, mang sắc xuân trở lại mỗi mùa Tết.

Sau những ngày Tết, việc lắng nghe các tín hiệu cảnh báo của cơ thể chính là bước quan trọng để bảo vệ sức khỏe lâu dài trong năm mới.

Không chỉ vàng hay heo quay, cá lóc nướng là lễ vật quen thuộc trong ngày vía Thần Tài của người miền Nam, mang ý nghĩa cầu tài lộc, may mắn và bứt phá đầu năm.

Chỉ vài thói quen nhỏ trước khi ngủ có thể giúp mái tóc giảm xơ rối, giữ độ ẩm tự nhiên và mềm mượt hơn khi thức dậy mà không cần tốn nhiều công chăm sóc.

Hạt macca giúp giảm cholesterol, hỗ trợ hệ tiêu hóa, làm đẹp da và tóc, đồng thời tăng cường sức khỏe xương và kiểm soát đường huyết.

Tiết trời nồm ẩm, mưa phùn đầu xuân khiến nguy cơ cảm cúm, bệnh hô hấp gia tăng. Giữ ấm, ăn uống hợp lý và sinh hoạt khoa học giúp bảo vệ sức khỏe hiệu quả.

Một số thói quen buổi giúp não bộ hoạt động hiệu quả, ngăn ngừa lão hóa, tăng cường tập trung và tinh thần sảng khoái để khởi đầu ngày mới.

Trữ nem rán đúng cách giúp duy trì chất lượng và an toàn thực phẩm, tránh nguy cơ nhiễm khuẩn, mất dinh dưỡng.

Khám phá 5 món salad ngon, bổ dưỡng giúp thanh lọc cơ thể, giảm mỡ và lấy lại vóc dáng sau kỳ nghỉ Tết hiệu quả, an toàn.

Bánh bao túi tiền không chỉ thơm ngon mà còn mang ý nghĩa tài lộc. Món bánh vàng ươm này được nhiều người chọn dâng cúng ngày vía Thần Tài, cầu may mắn đầu năm.

Mùa xuân miền Bắc là thời điểm vàng để trekking khi rừng xanh non, hoa đỗ quyên nở rộ và biển mây dày. Nhiều cung leo núi đẹp đang hút du khách mê khám phá.

Sau những ngày Tết nhiều thịt mỡ, bánh chưng dễ ngán, các món bún, phở nóng hổi với nước dùng thanh nhẹ sẽ giúp cả nhà đổi vị, ăn ngon mà vẫn nhẹ bụng.