Sáng 7/8, Hội đồng đạo đức, Bộ Y tế tổ chức cuộc họp thẩm định giai đoạn 1, giữa kỳ giai đoạn 2 vắc xin ngừa Covid-19 Nanocovax của Công ty Nanogen. Cuộc họp do GS Trương Việt Dũng, Chủ tịch Hội đồng đạo đức và Y sinh học quốc gia chủ trì.
Thứ trưởng Y tế Trần Văn Thuấn, Tổ trưởng Tổ công tác đặc biệt về nghiên cứu thử nghiệm lâm sàng, phát triển vắc xin phòng Covid-19 được mời tham dự.
Trưa cùng ngày, trao đổi với báo chí, đại diện Bộ Y tế cho biết, Hội đồng đạo đức đã thống nhất nghiệm thu kết quả thử nghiệm lâm sàng giai đoạn 1, giữa giai đoạn 2 vắc xin Nanocovax.
Bước đầu các chuyên gia đánh giá, vắc xin Nancovax an toàn, có tính sinh miễn dịch khá tốt, đặc biệt ở hàm lượng 25mcg. Vì vậy Hội đồng thống nhất cho phép nhóm nghiên cứu tiếp tục triển khai lâm sàng pha 3.
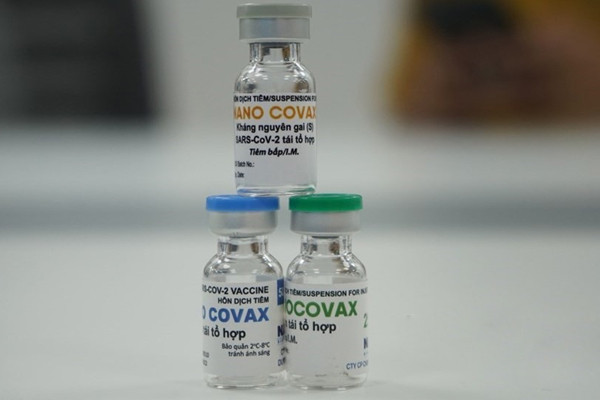
Vắc xin Nanocovax bước đầu được đánh giá an toàn, có tính sinh miễn dịch tương đối tốt. Ảnh: Lao Động
Theo Thứ trưởng Trần Văn Thuấn, tinh thần chung của Bộ Y tế rất ủng hộ, quyết liệt thúc đẩy các giải pháp, tạo mọi điều kiện thuận lợi nhất cả về hỗ trợ chuyên gia, vật chất, trang thiết bị, cơ sở để làm sao các đơn vị sớm nghiên cứu, phát triển thành công vắc xin ngừa Covid-19.
“Bộ Y tế đề nghị khẩn trương thành lập tổ hỗ trợ, giám sát, kiểm tra, phân tích số liệu và quy trình nghiên cứu vắc xin để đảm bảo tính độc lập, độ tin cậy trong thu thập, phân tích số liệu”, Thứ trưởng Thuấn nhấn mạnh.
Thứ trưởng đề nghị nhóm nghiên cứu, nhà sản xuất đưa quy trình thử nghiệm bổ sung tiêm mũi 3 để tăng tính sinh miễn dịch và hiệu lực bảo vệ, đồng thời xem xét nghiên cứu bổ sung hiệu quả vắc xin trên biến chủng Delta vào thời điểm phù hợp. Hiện chủng Delta đang lưu hành phổ biến tại Việt Nam và trên 130 quốc gia, vùng lãnh thổ.
Hội đồng đạo đức cũng đề nghị Công ty Nanogen cần đánh giá hiệu giá kháng thể trung hòa (hiệu quả bảo vệ của vắc xin) trên cỡ mẫu lớn hơn, khoảng 1.000 đối tượng. Trong báo cáo hỏa tốc của Nanogen gửi đi tối ngày 5/8, thử nghiệm đánh giá tính sinh miễn dịch mới thực hiện trên 112 tình nguyện viên tiêm vắc xin.
Thứ trưởng đề nghị các đơn vị nghiên cứu sau khi được thẩm định giai đoạn 1, giữa giai đoạn 2, cần khẩn trương hoàn thiện theo đóng góp của Hội đồng đạo đức.
Giao nhóm nghiên cứu sớm hoàn thiện báo cáo pha 3a (trên 1.000 tình nguyện viên), gửi về Cục KHCN & Đào tạo và Hội đồng đạo đức quốc gia để tổ chức sớm nhất buổi họp đánh giá, dự kiến diễn ra vào ngày 15/8.
Trước buổi họp 1 ngày, Tổ hỗ trợ, giám sát phải hoàn tất xong số liệu.
“Cuối cùng Bộ Y tế đề nghị sau khi có báo cáo pha 3a, nếu kết quả được đánh giá tốt, Hội đồng đạo đức sẽ có các đề xuất hợp lý với các cơ quan có thẩm quyền để xem xét cấp phép khẩn cấp Nanocovax”, Thứ trưởng Thuấn nhấn mạnh.
Vắc xin Nanocovax của Công ty Nanogen sử dụng công nghệ protein tái tổ hợp. Đây là vắc xin ngừa Covid-19 đầu tiên của Việt Nam thử nghiệm lâm sàng pha 3 trên 13.000 tình nguyện viên.