Đây là phiên họp thứ 2 của Hội đồng Đạo đức liên quan vaccine Nano Covax. Phiên họp trước đó diễn ra ngày 22/8. Nếu Hội đồng Đạo đức thông qua, hồ sơ sẽ được chuyển sang Hội đồng tư vấn cấp phép thuốc và vaccine.
Trước đó, cuộc họp này dự kiến được diễn ra từ ngày 15/9, khi Hội Đồng Đạo đức nhận được hồ sơ bổ sung của nhóm nghiên cứu vaccine Nano Covax theo yêu cầu của Thứ trưởng Bộ Y tế Trần Văn Thuấn, Tổ trưởng Tổ công tác đặc biệt về nghiên cứu thử nghiệm lâm sàng, phát triển vaccine Covid-19, tại cuộc họp ngày 10/9.
Tuy nhiên, đến trưa 15/9, hồ sơ được nhóm nghiên cứu bổ sung mới đến Bộ Y tế.
 |
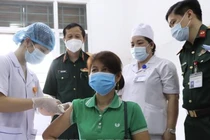
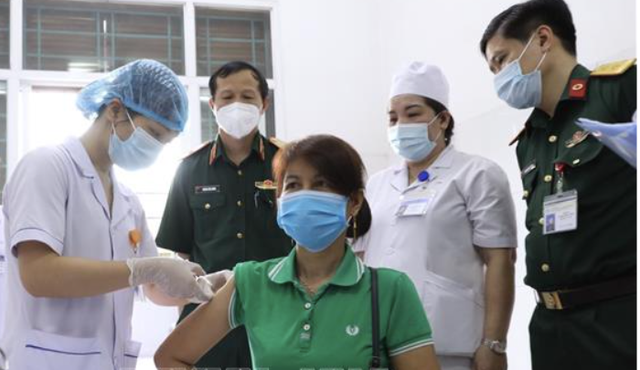
| Nano Covax là vaccine đầu tiên do Việt Nam nghiên cứu và sản xuất đã thử nghiệm lâm sàng xong giai đoạn 3. Ảnh: Nanogen. |
Trong cuộc họp do Phó thủ tướng Vũ Đức Đam chủ trì chiều 14/9, TS Nguyễn Ngô Quang, Phó cục trưởng Cục Khoa học công nghệ và Đào tạo (Bộ Y tế), Chánh Văn phòng Chương trình Quốc gia nghiên cứu phát triển, cho biết từ nay đến cuối năm 2021, Việt Nam sẽ có ít nhất có một vaccine được cấp phép khẩn cấp. Vaccine sẽ được triển khai tiêm trong nước từ đầu năm 2022.
Bộ Y tế sẽ thẩm định báo cáo kết quả giữa kỳ thử nghiệm lâm sàng giai đoạn 3a. Việc thẩm định này dựa trên báo cáo đầy đủ các kết quả xét nghiệm đánh giá tính sinh miễn dịch của Nano Covax và báo cáo giữa kỳ thử nghiệm lâm sàng giai đoạn 3b sớm khi nhận được hồ sơ của Tổ chức chủ trì nghiên cứu.
Trước đó, ngày 29/8, Hội đồng tư vấn cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc, đã họp và yêu cầu nhà sản xuất vaccine Nano Covax bổ sung thêm dữ liệu.
Về hồ sơ chất lượng: Hội đồng đề nghị Công ty Nanogen bổ sung, cập nhật một số nội dung theo ý kiến của Tiểu ban chất lượng theo hình thức cuốn chiếu.
Về hồ sơ dược lý, lâm sàng: Căn cứ kết quả thẩm định hồ sơ lâm sàng của Trung tâm Dược lý lâm sàng - Đại học Y Hà Nội và kết luận của Hội đồng Đạo đức ngày 22/8, Hội đồng tư vấn đề nghị Nanogen bổ sung, cập nhật thêm dữ liệu an toàn cho toàn bộ người đã được tiêm ít nhất một liều vaccine, giải thích rõ về các trường hợp sự cố bất lợi nghiêm trọng (SAE) tới nay.
Về tính sinh miễn dịch, công ty cần bổ sung, cập nhật dữ liệu theo đề cương sửa đổi mới nhất được Hội đồng Đạo đức thông qua, bao gồm đánh giá tính sinh miễn dịch trên các biến chủng mới (biến chủng Delta, biến chủng Alpha...). Ngoài ra, cỡ mẫu đánh giá tính sinh miễn dịch cần thực hiện theo đúng đề cương nghiên cứu đã được thông qua.
Về hiệu quả bảo vệ, Hội đồng tư vấn đề nghị Công ty Nanogen phối hợp nhóm nghiên cứu để phân tích, bàn luận về mối liên quan giữa tính sinh miễn dịch của vaccine và hiệu quả bảo vệ tối thiểu 50% (theo hướng dẫn của Tổ chức Y tế Thế giới) dựa trên các dữ liệu y văn.
Đến thời điểm này, Việt Nam có 3 vaccine (do Việt Nam nghiên cứu, phát triển và cả vaccine nhận chuyển giao công nghệ) đang thử nghiệm lâm sàng.
Trong đó, ứng viên Nano Covax là vaccine do Công ty Nanogen nghiên cứu, đến nay đã thử nghiệm lâm sàng xong giai đoạn 3 tại Học viện Quân Y, tỉnh Hưng Yên và tỉnh Long An.
Nếu được cấp phép, Nano Covax có thể sản xuất ngay 8-10 triệu liều/tháng và có thể nâng cấp lên 20-25 triệu liều/tháng.
Một số địa phương như Khánh Hoà, Bình Dương đã có văn bản xin được tiêm thử nghiệm lâm sàng giai đoạn 3 vaccine Nano Covax. Tuy nhiên, Bộ Y tế đã có văn bản cho biết việc đăng ký thử nghiệm lâm sàng cần phải đúng quy trình nghiên cứu.